がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
717)プテロスチルベン(Pterostilbene)の抗がん作用(その2):テロメラーゼ阻害作用とc-Myc阻害剤との相乗効果
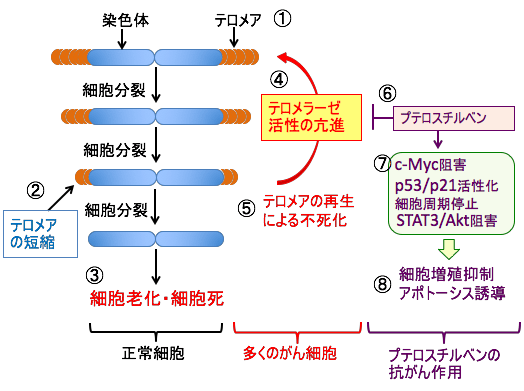
図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しており(④)、テロメアを再生することによって無限の分裂能(不死化)を獲得している(⑤)。プテロスチルベンはがん細胞のヒト・テロメラーゼ逆転写酵素の発現と活性を阻害してテロメラーゼ活性を阻害する(⑥)。さらに、プテロスチルベンはがん遺伝子のc-Mycの発現を阻害し、がん抑制遺伝子のp53やp21の活性を高め、細胞周期を停止し、STAT3やAkt経路を阻害する(⑦)。その結果、がん細胞の増殖を抑制しアポトーシスを誘導する(⑧)。
717)プテロスチルベン(Pterostilbene)の抗がん作用(その2):テロメラーゼ阻害作用とc-Myc阻害剤との相乗効果
【正常細胞は分裂できる回数に限界がある】
1960年代にアメリカの生物学者レオナルド・ヘイフリック(Leonard Hayflick)は、培養した正常細胞の分裂回数には限界があることを発見しました。
人間の胎児から取り出した線維芽細胞を培養すると次第に分裂の速度が落ちて、約50回の分裂回数が限界で、いくら栄養物質や増殖を促進する物質を加えても分裂することはできずに最後は死んでしまいます。
一方、成人の人間から取り出した線維芽細胞の分裂できる回数はその年齢に応じて減少していることも明らかになっています。
すなわち、細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は死を向かえるプログラムが働き出すのです。
このように、正常な細胞が分裂できる回数には限界があることを「ヘイフリックの限界(Hayflick Limit)」と言います。
ヒトの正常細胞の分裂回数は約50回が限界ということで、それ以上は分裂できないので、寿命があるということになります。
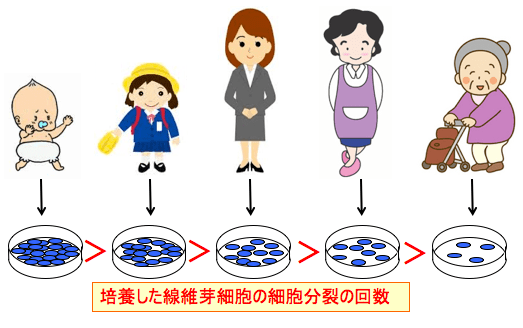
図:ヘイフリックの実験。赤ん坊や成人や老人の皮膚から線維芽細胞を採取してシャーレで培養すると、年齢が若い個体から採取した細胞ほど多く分裂できる。赤ん坊の細胞の方が老人より多く分裂できるが、赤ん坊の細胞もやがて細胞分裂を停止して死滅する。細胞の分裂回数はヒトの場合は約50回が限界で、これ以上は分裂できない。これをヘイフリック限界という。
【細胞分裂するたびにDNAのテロメアが短くなる】
細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は分裂できなくなります。細胞の分裂回数に限界を設けているのがテロメアです。
染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。この6塩基のリピート部分には遺伝情報が入っていないので、なくなっても遺伝子の発現には問題ない部分です。
しかし、テロメアが無くなると細胞はDNAの複製ができなくなります。
DNAは2本の鎖状で、それぞれの鎖を鋳型にして新しいDNA鎖を合成します。新しい鎖を作るとき、DNAポリメラーゼという酵素が鋳型のDNA上を移動しながら、新生DNAを作ります。
この酵素が鋳型のDNAに結合するためには、まずプライマーとよばれるRNAが鋳型のDNAの末端に結合する必要があります。
DNAポリメラーゼはRNAプライマーに結合し、そこから新生DNAの合成を開始します。その際、プライマーが結合した鋳型DNAの末端部は複製されません。そのため、細胞分裂でDNAを複製するたびに、染色体のDNA末端は少しづつ切れて短くなっていきます。
短くなっても問題ないように、最初から遺伝情報とは関係なく必要のないDNA配列(TTAGGGの繰り返し配列)がテロメアとして存在しているのです。
しかし、テロメアの長さに限界があるので、いずれはテロメアが無くなると、もはや細胞分裂ができなくなります。

図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなる(④)。
つまり、テロメアとは「命の回数券」のようなものであり、分裂する度に回数券を一枚づつちぎって使い、やがて使い切ってしまうと細胞の寿命がくるというわけです。
ちなみに生殖細胞や幹細胞(骨髄細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。
抗老化の研究分野では、テロメラーゼの活性を高めて幹細胞の分裂能を高め、組織や臓器の老化による機能低下を抑制することを目的にした治療法が研究されています。
一方、がん治療の領域では、がん細胞のテロメラーゼ活性を阻害できれば、がん細胞の無限の増殖能を阻止できます。
レスベラトロール類縁体のプテロスチルベンに、がん細胞のテロメラーゼ活性を阻害する効果が報告されています(後述)。
【がん細胞ではテロメラーゼ活性が亢進している】
細胞が分裂して増殖するには自身のDNAを複製する必要があります。
このDNAポリメラーゼによるDNA複製の仕組みではDNA鎖の両端(テロメアDNA)が完全には複製されず、徐々に失われていきます。これを末端複製問題(end replication problem)といいます。
通常、1回の細胞分裂で、テロメアから50から100塩基分が失われてテロメアが短縮していきます。
テロメアの短縮が限界に達すると、細胞はもはや分裂することが出来なくなります。
多くのがん細胞ではテロメラーゼ(telomerase)と呼ばれるテロメア合成酵素が活性化しており、この酵素の働きによってテロメアが安定に維持されます。
通常であれば、細胞分裂するたびにテロメアが短縮するのですが、がん細胞ではテロメラーゼ活性を亢進して、テロメアを再生して短縮を阻止しています。
がん細胞が無限に分裂出来るのはこのためです。

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しておりテロメアを再生できる(④)。その結果、がん細胞は無限の細胞分裂能(不死化)を獲得している(⑤)。
テロメラーゼ(telomerase)はテロメアの末端にTTAGGGのリピート配列を付加することで染色体DNAの末端を維持する酵素です。
テロメラーゼは逆転写酵素活性を持つヒト・テロメラーゼ逆転写酵素(human telomerase reverse transcriptase :TERT)と、テロメアリピートの鋳型として機能するRNA要素(テロメラーゼRNA要素)から構成されます。
テロメラーゼRNA要素(telomerase RNA component: TERC)はテロメラーゼによるテロメアの複製(逆転写)の際の鋳型として機能します。脊椎動物型TERC配列の50位付近に存在するCCCUAA配列が鋳型として機能します。
テロメラーゼ活性が低い細胞は、一般に細胞分裂ごとにテロメアの短縮が進み、やがてヘイフリック限界と呼ばれる細胞分裂の停止が起きます。
テロメラーゼは、ヒトでは生殖細胞・幹細胞・がん細胞などでの活性が認められ、それらの細胞が分裂を継続できる性質に関与しています。
このことから、テロメラーゼ活性を抑制することによるがん治療法となり、活性を高めることは細胞の分裂寿命の延長による抗老化療法となります。
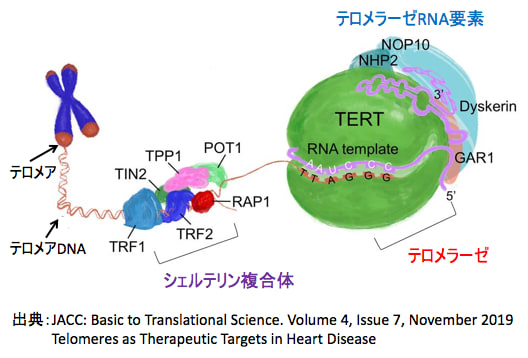
図:ヒト・テロメラーゼ複合体はヒト・テロメラーゼ逆転写酵素(human telomerase reverse transcriptase :TERT)とテロメラーゼRNA要素(telomerase RNA component :TERC)、dyskerin、リボヌクレオプロテイン(GAR1, NHP2, NOP10)から構成される。テロメラーゼRNA要素(TERC)がRNAテンプレートとなってテロメラーゼ逆転写酵素(TERT)がテロメアの末端にDNAヌクレオチドを追加してテロメアを伸長する。シェルテリン複合体(Shelterin complex)はテロメアを保護し、テロメラーゼ活性を制御する。シェルテリン複合体は、TRF1(telomere repeat binding factor 1)、 TRF2(telomere repeat binding factor 2)、RAP1(repressor/activator protein 1)、POT1(protection of telomere 1)、 TIN2(TRF1- and TRF2-interacting nuclear protein 2)、TPP1(ACD shelterin complex subunit and telomerase recruitment factorの6つのサブユニットから構成される。
【テロメラーゼ逆転写酵素はテロメア伸長以外の作用も有する】
テロメラーゼ逆転写酵素はテロメアを伸長するテロメラーゼ活性のほかに、発がん遺伝子のMycの発現を制御する作用があることが報告されています。以下のような報告があります。
Telomerase regulates MYC-driven oncogenesis independent of its reverse transcriptase activity(テロメラーゼはその逆転写酵素活性とは無関係にMYC駆動の発がんを制御する)J Clin Invest. 2015;125(5):2109-2122.
【要旨】
がん細胞では、MYCの活性化とテロメラーゼの再活性化がともに起こっていることが多い。テロメラーゼの再活性化は細胞複製の不死化に不可欠であると考えられており、MYCはその補因子とともに、がん細胞における増殖に必須の役割を担っている。
テロメラーゼの触媒サブユニットであるテロメラーゼ逆転写酵素(telomerase reverse transcriptase :TERT)の再活性化は、腫瘍におけるテロメラーゼ活性の再活性化を意味する。
テロメラーゼ逆転写酵素の再活性化は腫瘍におけるいくつかの「がんの特徴」の獲得と機能的に関連しているが、これらのメカニズムがテロメアに対するテロメラーゼの役割だけで説明できるかは不明である。
ここでは、テロメラーゼ逆転写酵素遺伝子欠損マウスが、MYC誘発リンパ腫の発症を抑制するが、テロメラーゼRNA要素(TERC)遺伝子欠損マウスではMYC誘発リンパ腫の発症を抑制しないことを示した。
テロメラーゼ逆転写酵素はがん細胞におけるMYC安定化の制御を行っていることを明らかにした。
テロメラーゼ逆転写酵素はクロマチン上のMYCレベルを安定化させ、その標的遺伝子の活性化または抑制に関与した。
テロメラーゼ逆転写酵素は、MYCユビキチン化とプロテアソーム分解を調節したが、この作用は逆転写酵素活性とテロメア伸長における役割とは無関係であった。
これらのデータに基づいて、がん細胞におけるMYCの直接の転写ターゲットであるテロメラーゼ逆転写酵素の再活性化は、MYC依存性発がんを増強するフィードフォワードメカニズム(feed-forward mechanism)を提供すると結論付ける。
テロメラーゼはテロメラーゼ逆転写酵素とテロメラーゼRNA要素の2つのサブユニットから構成されます。テロメアを伸長するテロメラーゼ活性にはこの2つのサブユニットが必要です。
「テロメラーゼ逆転写酵素遺伝子欠損マウスが、MYC誘発リンパ腫の発症を抑制するが、テロメラーゼRNA要素遺伝子欠損マウスではMYC誘発リンパ腫の発症を抑制しない」ということは、MYC誘発リンパ腫が、テロメラーゼの活性化とは関係ないが、テロメラーゼ逆転写酵素の存在は必要ということを示唆します。
これは、テロメラーゼ逆転写酵素はテロメラーゼ活性とは異なるメカニズムでMYC誘発性リンパ腫の発生に関与することを意味します。
フィードフォワード(feed-forward)とは、自動制御の一種で、『出力に変動を起こさせるような外乱を予測し、前もって打ち消してしまう制御方式。ふつう、フィードバック制御に付加して用いられる。』と解説されています。
テロメラーゼ逆転写酵素(TERT)はMYCの安定化と転写活性を亢進し、一方MYCは、TERTの転写を亢進します。このフィードフォワードメカニズム(feed-forward mechanism)の結果として、テロメラーゼ逆転写酵素活性とMYC活性の両方が増強し、MYC依存性発がんを増強するという機序です。
これをまとめると以下のような図になります。

図:テロメラーゼ逆転写酵素(telomerase reverse transcriptase:TERT)はテロメラーゼRNA要素(telomerase RNA component: TERC)と複合体を構成してテロメアを伸張する作用を発揮し(①)、細胞複製(DNA複製)を永続させて細胞を不死化する(②)。これがテロメラーゼ逆転写酵素のテロメア依存性作用となる(③)。一方、テロメラーゼ逆転写酵素(TERT)はテロメアとは関係なく、MYCタンパク質のユビキチン化を低下させてプロテアソームでの分解を低下し、MYCタンパク質の安定化を亢進し、クロマチン結合のMYC/MAXを増やし、MYC/MAX転写活性を亢進する(④)。MYCのターゲット遺伝子は細胞周期や細胞増殖や代謝の制御に関与し、これらのMYCの下流のターゲットの遺伝子発現の亢進によって発がんが強化される(⑤)。このMYC/MAXによる転写活性はテロメラーゼ逆転写酵素(TERT)の発現を亢進する(⑥)。このテロメラーゼ逆転写酵素のこの機能はテロメラーゼRNA要素(TERC)を必要とせず、テロメアに対する機能とは無関係(非依存性)である(⑦)。 このフィードフォワードメカニズム(feed-forward mechanism)の結果として、テロメラーゼ逆転写酵素活性が増強し、MYC依存性発がんを増強する。
【プテロスチルベンのテロメラーゼ活性阻害作用】
前述の論文では、MYCの阻害はテロメラーゼ逆転写酵素の発現を阻害することが報告されています。
ブルーベリーなどに含まれるプテロスチルベンがMYCを阻害してテロメラーゼ逆転写酵素の発現を阻害することが報告されています。以下のような論文があります。
Pterostilbene down-regulates hTERT at physiological concentrations in breast cancer cells: potentially through the inhibition of cMyc.(プテロスチルベンは乳がん細胞において生理的濃度でヒト・テロメラーゼ逆転写酵素の発現を抑制する: cMycの阻害を介する可能性) J Cell Biochem. 2018 Apr; 119(4): 3326–3337.
【要旨】
ヒト・テロメラーゼ逆転写酵素(Human telomerase reverse transcriptase :hTERT)は、テロメラーゼの触媒サブユニットであり、多くのがん細胞で発現が亢進している。
プテロスチルベンは、主にブルーベリーに含まれる天然のスチルベノイドで、抗菌物質(ファイトアレキシン)として機能し、抗酸化活性を示し、さまざまな種類のがん細胞の増殖を阻害する。
この研究は、生理学的に達成可能な濃度のプテロスチルベンが乳がん細胞の増殖を阻害し、hTERTの発現を抑制できるかどうかを明らかにする目的で行った。
我々は、プテロスチルベンが乳がん細胞のMCF-7とMDA-MB-231に対して細胞増殖を時間依存性と用量依存性の両方で抑制し、正常細胞のMCF10A細胞に対しては有意な毒性を示さないことを見出した。
プテロスチルベンはまた、両方の乳がん細胞株においてアポトーシスを増加させることが示された。
2種類の乳がん細胞(MCF-7およびMDA-231)において、プテロスチルベンは、用量依存的にG1およびG2 / M相での細胞周期を停止した。
hTERTの発現は、時間および用量依存的に、プテロスチルベン投与によって抑制された。
さらに、プテロスチルベンは両方の乳がん細胞株において、用量依存的にテロメラーゼレベルを低下させた。
さらに、プテロスチルベンによるhTERT阻害のターゲットと考えられるcMycは、 プテロスチルベン投与によってmRNAとタンパク質の両方で発現が抑制された。
以上の結果は、乳がんの発生と進行に対する天然の予防および治療剤としてのプテロスチルベンの有用性を示唆している。
プテロスチルベンを豊富に含む食品を摂取することで達成できるレベルの血中濃度で、ヒト・テロメラーゼ逆転写酵素の発現を抑制できると言う報告です。
さらに、プテロスチルベンはテロメラーゼ活性自体も阻害する作用があります。
c-Mycはテロメラーゼ逆転写酵素の遺伝子発現を亢進します。そして、プテロスチルベンはc-Mycの発現を阻害します。
【c-Mycタンパク質は転写因子】
c-Mycがテロメラーゼの発現と活性を亢進するので、c-Mycの発現や活性を阻害する治療法をプテロスチルベン治療に併用すると、テロメラーゼ阻害作用をさらに強化できる可能性があります。
そのためには、c-Mycについて理解する必要があります。
c-Mycはバーキットリンパ腫の原因遺伝子として見つかりました
バーキットリンパ腫(Burkitt lymphoma)は、主に小児に生じる悪性リンパ腫の種類の1つで、リンパ球の中のB細胞から発生するリンパ腫です。週単位で病気が進行する「高悪性度」に分類されます。人間のがんで最も増殖の速いがんと言われています。
中央アフリカで風土病となっており、米国では小児リンパ腫の約30%を占めます。
病名は、外科医のデニス・バーキット(Denis Parsons Burkitt)が1958年にアフリカで小児に発症する腫瘍を報告したことに由来します。
c-Myc遺伝子が染色体転座によりイムノグロブリン重鎖遺伝子のエンハンサーにより制御されるようになったことでc-MycがB細胞において過剰発現し、リンパ腫を引き起こします(下図)。
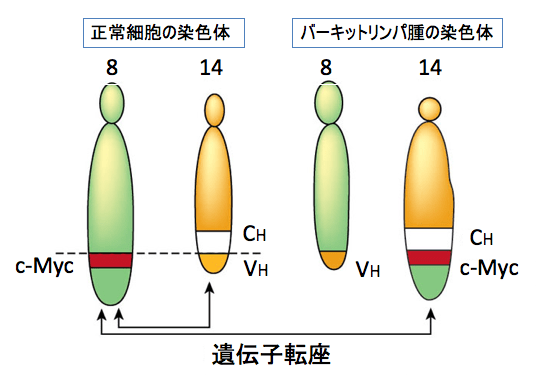
図:正常ではc-Myc遺伝子は8番染色体に存在し、イムノグロブリン(抗体)の重鎖(heavy chains)遺伝子は14番染色体に存在する。バーキットリンパ腫細胞では、c-Myc遺伝子がイムノグロブリン重鎖遺伝子のエンハンサー(CH)の下流に転座している。その結果、c-Myc遺伝子が過剰発現して、B細胞が腫瘍化する。
c-Mycのcはcellular(細胞の)のcであり、トリ白血病ウイルスがもつv-Myc遺伝子の細胞性のカウンターパートして同定された遺伝子です。バーキットリンパ腫細胞の原因遺伝子として発見されたあと、多くの種類のがんにおいて, c-Mycタンパク質の安定性が向上する変異や遺伝子増幅による発現上昇などが認められてます。
c-Mycは細胞のがん化に深くかかわる遺伝子として古くから知られており、さらに幹細胞維持にも関わっていることや、iPS細胞誘導のための初期化因子の一つであることが示されています。
c-Mycは細胞増殖や嫌気的代謝を促進する因子としてがん細胞の特質に大いにかかわっている遺伝子であり、その遺伝子産物であるc-Mycタンパク質はパートナー因子であるMax(MYC-associated protein X)と相互作用することで転写因子として機能します。
さらに、c-Mycタンパク質は遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きもあります(下図)。

図:Mycタンパク質による標的遺伝子の転写活性化。
(上)MycはMaxと二量体を形成し、E-box(Enhancer box)と呼ばれるCACGTG配列に結合し、クロマチン構造を制御するタンパク質(GCN5, TIP60, TIP48, TRRAPなど)をリクルートし遺伝子転写を活性化する。GCN5 とTIP60はヒストンアセチル基転移酵素、TIP48はATP結合タンパク質、TRRAPは形質転換/転写ドメイン関連タンパク質。
(下)Mycタンパク質はE-boxのみでなく、遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きがある。(出典:Signal Transduct Target Ther. 2018; 3: 5.)
c-Mycは細胞内の様々な機能を制御しています。タンパク質をコードしている遺伝子だけでなく、タンパク質をコードしていない遺伝子の制御にも関わっており、細胞周期、タンパク質合成、細胞接着、代謝、シグナル伝達、遺伝子転写、タンパク質翻訳、など多くの細胞機能を制御しています。(下図)

図:Mycは様々な遺伝子の転写を制御し、多彩な細胞機能の制御に関与している。
【Wnt/β-カテニン経路の活性化はc-Mycの発現を亢進する】
Wntシグナルは種を超えて広く保存されたシグナル伝達経路で、遺伝子発現、細胞増殖、細胞運動、細胞極性などを調節することで、発生や幹細胞の維持、発がんなどに深く関与することが知られています。
特にβカテニンを介するWnt/β-カテニン・シグナル伝達系は多くのがん細胞で異常を起こしており、がん治療の重要なターゲットになっています。
βカテニンは781個のアミノ酸からなる92kDaのタンパク質で、細胞間接着と遺伝子発現調節の2つの働きを持っています。
βカテニンの大部分は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリン(E-Cadherin)と会合体を作っています。このような細胞膜の接着部位のβカテニンはE-カドヘリンとアクチン細胞骨格との連結を助けています。
E-カドヘリンと会合していないβカテニンはすべて細胞質で複数のタンパク質からなる大型の分解複合体により分解されています。
しかし、Wnt(ウィント)という分子量約4万の分泌性糖タンパク質が受容体に結合すると、細胞質におけるβ-カテニンの分解が阻止されて細胞質に蓄積し、核内に移行した後, 転写因子のTcf/Lef(T cell factor/ Lymphoid enhancer factor)と複合体を形成し、Tcf/Lefの転写活性を亢進します。
つまり、β-カテニンはTcf/Lefの転写活性化補助因子として機能し、Tcf/Lefの標的遺伝子の転写を誘導します。このシグナル伝達系をWnt/β-カテニン経路と言い、この経路のターゲット遺伝子にc-Mycが含まれます。(下図)

図:β-カテニンは細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβ-カテニンはリン酸化され、ユビキチン化を受けて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβ-カテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。β-カテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTCF(T cell factor)と複合体を形成する(⑥)。βカテニンにより活性化される遺伝子群にはc-Mycや cyclinD1など細胞の増殖を促進する因子が含まれ(⑦)、その結果、細胞の増殖が亢進する(⑧)。
β-カテニンは細胞膜近傍か細胞質・核のどちらかに局在し, 特に核にあるときは一連の遺伝子発現に影響を与えると考えられています。
Wnt/β-カテニン・シグナル伝達系により活性化される遺伝子群にはc-Myc、 c-Jun、 cyclinD1など細胞の増殖や転移を促進する因子が含まれます。つまり、Wnt/β-カテニン・シグナル伝達系が活性化されると、がん細胞の増殖や転移が促進されることになります。
がん細胞ではWnt/β-カテニン経路の異常が高頻度で認められます。Wnt/β-カテニン経路は極めて複雑で、まだ不明な点も多くあります。簡単にまとめると、次のようになります。
① Wntは分子量約4万の細胞外分泌糖タンパク質で、種を超えて保存されており、初期発生における体軸の決定や器官形成を制御しています。これまでに哺乳類において19種類のWnt が同定されています。
② Wnt はFrizzledやLRP5/6の受容体を介して細胞内にシグルを伝達し、多様な細胞機能を制御しています。Frizzledは7回膜貫通型受容体でLRP5/6はFrizzledの共役受容体として機能します。
③ Wnt の非存在下では細胞質内のβ-カテニンのタンパク質量は低く保たれています。これはGSK-3がβ-カテニンをリン酸化し、リン酸化された-カテニンはユビキチン化を受け、最終的にはプロテアソームで分解されるためです。
④ Wnt が分泌されて細胞膜上のFrizzled と共役受容体であるLRP5/6に結合すると,そのシグナルは細胞内へと伝達され、GSK-3依存性のβ-カテニンのリン酸化を抑制し、低リン酸化状態となったβ-カテニンはプロテアソームによる分解から免れ、細胞質内に蓄積します。
⑤ 細胞内に蓄積したβ-カテニンは核内に移行し、転写因子Tcf/Lef と複合体を形成して標的遺伝子の発現を促進することによって、種々の細胞機能を制御しています。Tcf/LefはT-cell factor/lymphoid enhancer factorの略です。
⑥ Tcf/Lefの標的遺伝子は100種類以上に及び、細胞の増殖、分化、運動、幹細胞多能性維持などの制御に関わっています。c-mycやcyclin D1などの発現を亢進して細胞増殖を促進します。(下図参照)
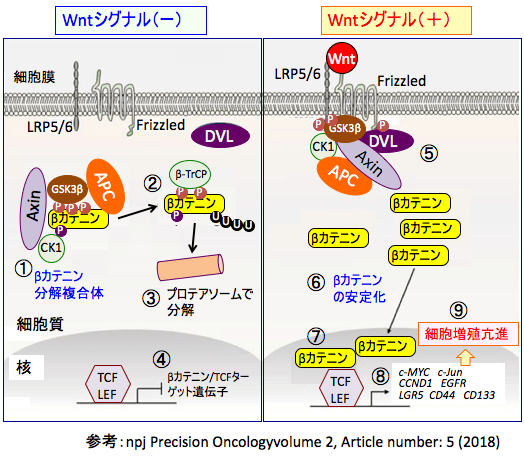
図:(左)Wntのシグナルが無い状況では、β-カテニンは細胞質内で分解複合体によってリン酸化され(①)、ユビキチン(U)が結合し(②)プロテアソームで分解されている(③)。その結果、Tcf/Lef(T-cell factor/lymphoid enhancer factor)による遺伝子発現が阻止されている(④)。
(右)Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されると、分化複合体が不活性化され、β-カテニンのリン酸化が阻止されて(⑤)β-カテニンは分解されなくなり(⑥)、細胞質内で増加し核内に移行して転写因子のTCFに結合し(⑦)、β-カテニン/TCFのターゲット遺伝子の転写を活性化して(⑧)、細胞の増殖を亢進する(⑨)。
βカテニン分解複合体は、AXIN、APC(adenomatous polyposis coli) 、セリン・スレオニンキナーゼのGSK3β(glycogen synthase kinase-3)、CK1α (casein kinase 1α)から構成され、GSK3βとCK1αがβカテニンをリン酸化する。βカテニンがリン酸化されるとβ‑TrCP E3 linker によってユビキチンが結合して、プロテアソームで分解される。
(参考:参考:npj Precision Oncologyvolume 2, Article number: 5 (2018) )
【駆虫薬のメベンダゾールはWnt/βカテニンによる遺伝子発現を阻害する】
Wnt/β-カテニン・シグナル伝達系の阻害はがん治療のターゲットとして重要視されています。駆虫薬のメベンダゾールがWnt/β-カテニン・シグナル伝達系の最下流の遺伝子発現レベルで阻害作用を示すことが報告されています。以下のような報告があります。
Comprehensive Modeling and Discovery of Mebendazole as a Novel TRAF2- and NCK-interacting Kinase Inhibitor.(包括的モデリングと新規TRAF2およびNCK相互作用キナーゼ阻害剤としてのメベンダゾールの発見)Sci Rep. 2016 Sep 21;6:33534. doi: 10.1038/srep33534.
【要旨】
TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)は、Wntシグナル系が活性化した結腸直腸がんの重要なターゲットの1つである。この研究では、2つのデータセットを選び、望ましい生物医薬品特性を有する新規なTNIK阻害剤を探索するための包括的なモデリング研究を行った。
データセットIを用いて、比較分子類似性指数分析(Comparative Molecular Similarity Indices Analysis :CoMSIA)および可変選択k-最近傍モデル(variable-selection k-nearest neighbor models)を導出し、そこからTNIK阻害剤活性にとって決定的な3D分子場(3D-molecular fields)および2D記述子(2D-descriptors)が明らかにされた。
データセットIIに基づいて、予測的なCoMSIA-SIMCA(Soft Independent Modelling by Class Analogy)モデルを取得し、1,448種類の FDA(米国食品医薬品局)承認の小分子薬物のスクリーニングに使用した。
実験的評価の結果、FDA承認の駆虫薬であるメベンダゾールは、解離定数Kd =〜1μMでTNIKキナーゼ活性を選択的に阻害することができることを発見した。その後のCoMSIAおよびkNN分析は、メベンダゾールがTNIKを結合および阻害するのに必要な好ましい分子特性を有することを示した。
理解困難な用語や解析法が並んでいますが、簡単に言うと、コンピュータを使った構造解析や結合活性の解析でメベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性を報告しています。
がん治療薬の開発では、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性や安全性や薬物動態が検討されます。
さらに最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)は結腸直腸がんの増殖活性の維持に必須であることが報告されています。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要だと言うことです。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望だという報告です。
以下のような報告もあります。メベンダゾールの抗腫瘍効果にc-Mycが関与しているという報告です。
Mebendazole induces apoptosis via C-MYC inactivation in malignant ascites cell line (AGP01).(メベンダゾールは悪性腹水細胞株AGP01においてC ‐ MYC不活性化を介してアポトーシスを誘導する)Toxicol In Vitro. 2019 Jun 14;60:305-312.
【要旨の抜粋】
メベンダゾールは、悪性腹水細胞のAGP01細胞のDNA損傷を有意に増加させたが、正常ヒトリンパ球に対してはDNA損傷を引き起こさなかった。
メベンダゾールは、0.5μMおよび1.0 μMの濃度で、それぞれG0/G1 および G2/M期において顕著な細胞周期停止を引き起こし、そしてより高濃度で有意にアポトーシスを誘導した。さらに、メベンダゾール(0.5μM と 1.0 μM)はカスパーゼ3および7の活性を増加させた。
メベンダゾールは、AGP01細胞におけるC-MYC mRNA とC-MYCタンパク質発現を減少させた。 メベンダゾールは、同じ濃度において、AGP01 shRNA MYCと比較して、AGP01細胞においてより細胞生存率を低下した。
したがって、我々の結果は、メベンダゾールが胃がん細胞において細胞死を誘導する経路の1つとしてC-MYC遺伝子の関与を示唆している。
shRNAは、RNA干渉による遺伝子サイレンシングのために用いられるヘアピン型のRNA配列です。AGP01 shRNA MYCはAGP01細胞にc-Myc遺伝子の発現を不活性化するshRNAを導入した細胞です。
c-Mycに依存性の高いがん細胞に対してメベンダゾールがc-Myc発現を阻害してアポトーシスを誘導する機序を示唆しています。
以下の報告もメベンダゾールの抗腫瘍効果にc-Mycの関与を報告しています。
Anthelmintic mebendazole enhances cisplatin's effect on suppressing cell proliferation and promotes differentiation of head and neck squamous cell carcinoma (HNSCC).(駆虫薬メベンダゾールはシスプラチンの細胞増殖抑制効果を高め、頭頸部扁平上皮癌の分化を促進する。)Oncotarget. 2017 Feb 21;8(8):12968-12982.
【要旨の抜粋】
駆虫薬メベンダゾールを頭頸部扁平上皮がんの治療薬として再利用する可能性を検討する。
一般的に使用されている2種類のヒト頭頸部扁平上皮がん細胞株のCAL27およびSCC15を使用して、メベンダゾールがヒト頭頸部扁平上皮がん細胞においてシスプラチンよりも強力な抗増殖活性を発揮することを示す。
メベンダゾールは頭頸部扁平上皮がん細胞の細胞増殖、細胞周期進行および細胞移動を効果的に阻害し、そしてアポトーシスを誘導する。
メカニズム的には、メベンダゾールはELK1/SRF、AP1、STAT1/2、MYC/MAXを含むがん関連経路を制御する。 メベンダゾールはまた、頭頸部扁平上皮がん細胞の細胞増殖の抑制およびアポトーシスの誘導においてシスプラチンと相乗的に作用する。
さらに、メベンダゾールは、CAL27細胞の最終分化およびCAL27細胞の異種移植腫瘍の角質化を促進する。
これらの結果は、メベンダゾールが特定の頭頸部扁平上皮がん細胞の分化を促進しながら増殖を阻害することによってその抗がん活性を発揮し得ることを実証した最初のものである。
駆虫薬のメベンダゾールは、頭頸部扁平上皮がん治療においてシスプラチンなどの他の化学療法薬と組み合わせて使用される安全かつ有効な薬剤として再利用され得ると考えられる。
がん治療以外で使用されている医薬品の抗がん作用をスクリーニングして、がん治療に利用できる薬を見つけようという医薬品再利用においてメベンダゾールは有力な候補として研究されています。以下のような報告もあります。
Repositioning of the anthelmintic drug mebendazole for the treatment for colon cancer.(寄生虫治療薬メベンダゾールの大腸がん治療薬としての再開発)J Cancer Res Clin Oncol. 139(12): 2133-40, 2013年
【要旨の抜粋】
大腸がんの治療薬として再開発する目的で、臨床的に使用されている1600種類の医薬品を含む多数の物質をスクリニーングした。
2種類の大腸がん細胞において、10μMの濃度で細胞生存率を40%以下に減らす細胞傷害活性を示す物質が68種類スクリーニングされた。これらの物質は遺伝子発現の解析から幾つかの種類に分類され、その一つが寄生虫治療薬のベンゾイミダゾール(Benzimidazole)系の薬物であった。
このうちメベンダゾール(Mebendazole)とアルベンダゾール(Albendazole)が臨床で使用されていた。
NCIの60種類のがん細胞株を用いた薬剤感受性のデータベースとの比較から、メベンダゾールとアルベンダゾールの類似性は低く、作用機序が異なることが示唆された。Connectivity Map解析による遺伝子発現パターンの比較でも、この2つの類似性は低かった。
さらに、メベンダゾールはBCR-ABLやBRAFを含む幾つかのプロテインキナーゼと相互作用を示したが、アルベンダゾールにはそのような作用は認めなかった。
メベンダゾールはNCA60パネルの大腸がん細胞株の80%に対して抗腫瘍活性を示した。さらに3種類の大腸がん細胞と3種類の非がん細胞での検討から、メベンダゾールの大腸がんに対する選択性が確認された。
以上の結果から、メベンダゾールは大腸がん治療薬として再開発する価値がある。
メベンダゾールはがんの代替医療ではかなり有名です。
2019年5月にある記事がインターネット上に掲載されました。
タイトルは「がんが全身に転移 – 余命3ヶ月3ヶ月の男性が犬の駆虫薬で完治?」となっています(日刊ゲンダイDIGITAL)。
米国に住む男性は、小細胞肺がんが全身に転移し、手の施しようのない状態になり、余命は3カ月ほどと宣告されました。
その男性は獣医の勧めで犬の駆虫薬のフェンベンダゾールの服用を開始しました。そして3カ月後、PET(放射断層撮影法)スキャンを受けたところ、がんがきれいに消滅していたというのです。
この治療を勧めた獣医は、犬の駆虫薬のフェンベンダゾールが動物実験でがん細胞を死滅させる作用が報告されていることを知っていたので、フェンベンダゾールの服用を勧めたそうです。
フェンベンダゾールとメベンダゾールはベンズイミダゾール系といわれる化合物で、フェンベンダゾールは動物用の駆虫薬で、メベンダゾールは人間用の駆虫薬として使用されています。
人間用のメベンダゾールはがんの代替療法として私も2014年頃からがん治療に使用しており、その有効性を経験しています。
駆虫薬として入手は容易で、副作用も極めて少ない薬です。がんに対する有効性も証明されています。
メベンダゾールの消化管からの吸収が低いのが欠点ですが、油の多い食事の後に服用すると吸収率を高めることができますので、ケトン食との併用は有効です。
また、メベンダゾールを分解する薬物代謝酵素を阻害するグレープフルーツや胃薬のシメチジンを併用すると、メベンダゾールの血中濃度を高めることができます。メベンダゾールの抗腫瘍効果については401話で紹介しています。
【BETファミリータンパク質のBRD4がc-Myc遺伝子の転写に関与】
c-Mycは転写レベルでの調節や、RNAおよびタンパク質の安定性での調節といったように、様々なレベルでの調節を受けています。
c-Myc mRNAはかなり不安定であり、c-Myc遺伝子が強く転写されても、細胞内でc-Myc mRNAは蓄積しがたく、さらにc-Myc mRNAは,let-7などいくつかのmiRNAによる翻訳の抑制も受けています。
c-Mycタンパク質の58番目のスレオニン残基がGSK-βによってリン酸化を受けると、プロテオソーム分解系によりすみやかに分解されます。
このようにc-Mycタンパク質は、正常細胞では細胞内にあまり多く蓄積しないようにさまざまな調節を受けています。しかし、がん細胞はそういったc-Mycタンパク質の量を制限する機構から回避することで細胞内に比較的多くの量のc-Mycタンパク質の蓄積を達成しています。
その最も典型的な例としては、がん細胞がリン酸化されないように58番目のスレオニン残基を変異させることで、c-MycCタンパク質の安定性を増していることがあげられます。
転写レベルでの調節では、c-Myc遺伝子プロモーター上にBRD4(ブロモドメイン含有タンパク質4)という転写調節因子が結合し、転写を促進していることがわかっており、小分子化合物を用いてBRD4の活性を抑制することでc-Mycの発現を低下させ、がんを治療しようとする試みがなされています。
BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。
ブロモドメインはヒストンのアセチル化リシンを認識し,制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。
ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
ヒストンのアセチル化による遺伝子発現の制御には、アセチル化を促進するヒストンアセチル基転移酵素、ヒストンからアセチル基を除去するヒストン脱アセチル化酵素、ヒストンのアセチル化した部分を認識するBETファミリータンパク質の3つが必要ということです。
ヒストンアセチル基転移酵素の「書き屋(Writer)」とヒストン脱アセチル化酵素の「消し屋(Eraser)」と、BETファミリータンパク質の「読み屋(Reader)」の3つの役割を担うタンパク質が、ヒストンアセチル化の制御を行ってます。(下図)

図:「書き屋(Writer)」のヒストンアセチル基転移酵素によってヒストンにアセチル基が結合し(①)、「消し屋(Eraser)」のヒストン脱アセチル化酵素によってアセチル基が除去される(②)。ヒストンアセチル化の少ない部分では遺伝子転写は抑制される(③)。「読み屋(Reader)」のBETファミリータンパク質はヒストンのアセチル化リシンと結合して(④)、遺伝子転写を促進する(⑤)。
ヒストンのアセチル化リシンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。
ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)が、がんや炎症性疾患の治療薬として注目されています。臨床試験が行われているBET阻害剤が幾つかあります。
このようなBET阻害剤は、ある種のがん細胞に投与すると腫瘍促進遺伝子の発現を選択的に抑制することから、がん治療薬としての可能性が期待されています。
【ニトロキソリンはBETタンパク質を阻害する】
抗生物質のニトロキソリンがBETタンパク質を阻害することが報告されています。以下のような論文があります。
Discovery of novel BET inhibitors by drug repurposing of nitroxoline and its analogues.(ニトロキソリンとその類似体の薬物再利用による新規BET阻害剤の発見)Org Biomol Chem. 2017 Nov 15;15(44):9352-9361.
【要旨の抜粋】
ブロモドメイン含有タンパク質のBETファミリーは、がん、炎症および心血管疾患を含む多くの疾患の治療に有望な薬物標的であると考えられている。それ故、BET阻害作用のある新規な化合物の開発が注目されている。
安全性および薬物動態が既知の化合物から阻害剤を見出すという薬物再利用戦略は大きな利点を有しており、それ故近年の医薬品開発者の関心を高めている。この薬物再利用戦略を使って、薬物ライブラリーからBRD4特異的阻害作用を有する化合物を探索し、続いてALPHAスクリーニングアッセイ試験を実施した。
FDA承認抗生物質であるニトロキソリンは、BRD4(ブロモドメイン含有タンパク質4)の第一ブロモドメインとアセチル化ヒストン4ペプチドとの間の相互作用を50%阻害濃度(IC50)が0.98μMで阻害することを明らかにした。
ニトロキソリンは、非BETブロモドメイン含有タンパク質に対して阻害作用を示さず、良好な選択性で全てのBETファミリーメンバーを阻害した。従ってニトロキソリンは選択的BET阻害剤と呼べる。
ニトロキソリンは細胞周期停止とアポトーシスを誘導することによりMLL白血病細胞の増殖を効果的に抑制した。ニトロキソリンの有効性は、少なくとも部分的には、BETの阻害および標的遺伝子転写の抑制によるものである。
BET阻害剤としてのニトロキソリンの発見は、BETファミリー関連疾患の治療のためのニトロキソリンおよびその誘導体の潜在的用途を示唆している。
BET (bromodomain and extra-terminal)ファミリータンパク質は、ブロモドメインにおいてヒストンのアセチル化されたリシンを認識することにより、転写活性化因子として機能します。BRD4はこのようなBETファミリータンパク質の1つです。
BETファミリータンパク質のBRD4の阻害剤(=ニトロキソリン)はc-Mycの発現を抑制する作用があると言えます。

図:ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質の一つのBRD4は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどをリクルートして(①)、c-Myc遺伝子の転写を促進する(②)。ニトロキソリンはBRD4の第一ブロモドメインとアセチル化ヒストンの結合を阻害する(③)。その結果、転写因子やRNAポリメラーゼのリクルートが阻害され(④)、c-Myc遺伝子の転写を抑制する(⑤)。
ニトロキソリンの尿路感染症の治療に使う量は1日に500から750mgです。この尿路感染症に使用する服用量で十分な抗腫瘍効果が期待できることが動物実験の研究で報告されています。
以上のような報告から、テロメラーゼとc-Mycの阻害を目的としたがん治療法として、プテロスチルベン+メベンダゾール(+シメチジン)+ニトロキソリンの併用は試してみる価値はあります。(下図)

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しており(④)、テロメアを再生することによって無限の分裂能(不死化)を獲得している(⑤)。テロメラーゼはテロメラーゼRNA要素とテロメラーゼ逆転写酵素の2つのサブユニットから構成され(⑥)、テロメラーゼ逆転写酵素はc-Mycによって転写が亢進される(⑦)。テロメラーゼ逆転写酵素はテロメア非依存性機序によってc-Mycの安定性を高め、c-Mycの転写活性を亢進する(⑧)。c-Mycはがん細胞の増殖を促進し、細胞死を抑制する(⑨)。プテロスチルベン、メベンダゾール、ニトロキソリンはc-Mycを阻害する機序によって、c-Myc依存性およびテロメラーゼ依存性の機序によってがん細胞の増殖を阻害し、細胞死を誘導する(⑩)。
● プテロスチルベンのサプリメントについてはこちらへ:
| « 716)プテロス... | 718)プテロス... » |



