前回の続き、中和の考え方です。
前回は、酸性の水溶液とアルカリ性の水溶液をいい具合に混ぜ合わせると、
中性の水溶液ができることを解説しました。
では、いい具合でなかったら、どうなるのでしょう?
まず酸性の塩酸とアルカリ性の水酸化ナトリウム水溶液をいい具合に混ぜ合わせるおさらいです。

こんな感じの2つの水溶液を混ぜ合わせると
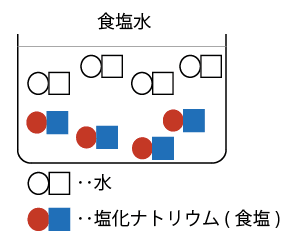
こういう感じに中性の食塩水ができあがるのでしたね。
ちなみにこのできあがった食塩水を加熱して水分を蒸発させますと
こんな風に、固体である塩化ナトリウム(食塩)がビーカーの中に残ります。
では、塩酸の中に、ちょっと少なめに水酸化ナトリウム水溶液を入れてみましょう。

そうすると、やはりあら!あっちの方がいい感じ!とばかりに
溶けている塩化水素やら水酸化ナトリウムやらが相手を変えようとします。

無事お相手を見つけて新たなカップルが誕生したのですが、あら、
あぶれた塩化水素が残ってしまっていますね。

こういう感じで、ちょうどいい具合でない場合は
中和する相手がいなくて余った方はそのまま変化せずに水溶液の中に残ってしまうのです。
できあがった水溶液の中には、中和でできた塩化ナトリウム(食塩)
 と
と
中和の相手がいなくて余ってしまった酸性の塩化水素

が溶けていることになり、全体として酸性の水溶液になるのです。
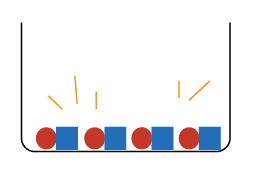
そしてこのできあがった酸性の水溶液を加熱して水分を蒸発させると
ビーカーの中には
こんな感じで、中和でできた塩化ナトリウム(食塩)だけが残ります。
反応せずに残っていた塩化水素は気体なので、どこかにいってしまうのです。
では次は、水酸化ナトリウム水溶液の中に、ちょっと少なめに塩酸を加えてみましょう。

先ほどと同じように、溶けているやつらは相手を変えようとして‥
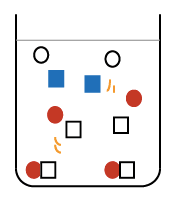
今度は水酸化ナトリウムが余ってしまいました。
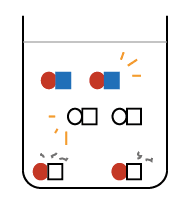
できあがった水溶液の中には中和でできた塩化ナトリウム(食塩) と
と
中和の相手がいなくて余ってしまったアルカリ性の水酸化ナトリウム が溶けているので、
が溶けているので、
全体でアルカリ性の水溶液になります。
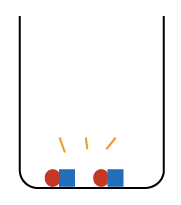
この水溶液を加熱して水分を蒸発させると、ビーカーの中には

今度は中和してできた塩化ナトリウム(食塩) と
と
もとから溶けていた固体の水酸化ナトリウム が残ります。
が残ります。
このように、酸性の水溶液とアルカリ性の水溶液をちょうどいい具合でない割合で混ぜ合わせると
中和できなかった物質の方が水溶液の中にそのまま残るので
中性の水溶液にはならないのでした。
以上が中和の考え方です。
この考え方をふまえて、中和の問題を解いていきましょう。
3はこちら→中和の考え方3
*おまけ*
ワークシート

パスワード:work
確認プリント

パスワード:tyuuwa
ダウンロードしてお使いください!
前回は、酸性の水溶液とアルカリ性の水溶液をいい具合に混ぜ合わせると、
中性の水溶液ができることを解説しました。
では、いい具合でなかったら、どうなるのでしょう?
まず酸性の塩酸とアルカリ性の水酸化ナトリウム水溶液をいい具合に混ぜ合わせるおさらいです。

こんな感じの2つの水溶液を混ぜ合わせると

こういう感じに中性の食塩水ができあがるのでしたね。
ちなみにこのできあがった食塩水を加熱して水分を蒸発させますと

こんな風に、固体である塩化ナトリウム(食塩)がビーカーの中に残ります。
では、塩酸の中に、ちょっと少なめに水酸化ナトリウム水溶液を入れてみましょう。

そうすると、やはりあら!あっちの方がいい感じ!とばかりに
溶けている塩化水素やら水酸化ナトリウムやらが相手を変えようとします。

無事お相手を見つけて新たなカップルが誕生したのですが、あら、
あぶれた塩化水素が残ってしまっていますね。

こういう感じで、ちょうどいい具合でない場合は
中和する相手がいなくて余った方はそのまま変化せずに水溶液の中に残ってしまうのです。
できあがった水溶液の中には、中和でできた塩化ナトリウム(食塩)
 と
と中和の相手がいなくて余ってしまった酸性の塩化水素

が溶けていることになり、全体として酸性の水溶液になるのです。
そしてこのできあがった酸性の水溶液を加熱して水分を蒸発させると
ビーカーの中には

こんな感じで、中和でできた塩化ナトリウム(食塩)だけが残ります。
反応せずに残っていた塩化水素は気体なので、どこかにいってしまうのです。
では次は、水酸化ナトリウム水溶液の中に、ちょっと少なめに塩酸を加えてみましょう。

先ほどと同じように、溶けているやつらは相手を変えようとして‥

今度は水酸化ナトリウムが余ってしまいました。

できあがった水溶液の中には中和でできた塩化ナトリウム(食塩)
 と
と中和の相手がいなくて余ってしまったアルカリ性の水酸化ナトリウム
 が溶けているので、
が溶けているので、全体でアルカリ性の水溶液になります。
この水溶液を加熱して水分を蒸発させると、ビーカーの中には

今度は中和してできた塩化ナトリウム(食塩)
 と
ともとから溶けていた固体の水酸化ナトリウム
 が残ります。
が残ります。このように、酸性の水溶液とアルカリ性の水溶液をちょうどいい具合でない割合で混ぜ合わせると
中和できなかった物質の方が水溶液の中にそのまま残るので
中性の水溶液にはならないのでした。
以上が中和の考え方です。
この考え方をふまえて、中和の問題を解いていきましょう。
3はこちら→中和の考え方3
*おまけ*
ワークシート

パスワード:work
確認プリント

パスワード:tyuuwa
ダウンロードしてお使いください!









