久しぶりに、Covid-19関連の論文をざっと和訳して紹介してみようと思います。今回は、今年4月24日に公開された論文"Effect of High vs Low Dose of Chloroquine Diphosphate as Adjunctive Therapy for Patients Hospitalized With Severe Acute Respiratory Syndrome Coronavirus 2(SARS-CoV-2) Infection. A Randomized Clinical Trial."(Borba MGS, Val FFA. et al. JAMA Network Open. 2020;3(4):e208857)を参照しました。
(1) Introduction
Chloroquine diphosphate(CQ)とhydrochloroquine(HCQ)はマラリアだけでなく、リウマチ治療にも用いられてきた。HCQはCQの誘導体であるが、長期使用においてはCQに比べて毒性が低いことが証明されており, SLEと関節リウマチの治療に推奨されている。なおCQは、長期使用により眼球に蓄積して網膜毒性を来す可能性のほか、筋炎との関連も報告されている。他に、短期間の使用でも起こる主な副作用としてQTc間隔の延長も挙げられる。1960年代末、CQの試験管内における抗ウイルス活性が初めて特定された。2つのstudyにおいてCQの抗SARSコロナウイルス活性が証明されたが、抗ウイルス作用を発揮するには高濃度が必要であった。
CQの効果は肺炎の悪化を抑制し, 胸部画像所見を改善, ウイルスの陰性化を促進, 病勢を改善させ、明らかにcontrol治療群より優れていた。HCQによる治療を受けたCovid-19患者20名(うち6名はアジスロマイシン併用)では、HCQ治療群とcontrol治療群間で鼻咽頭サンプル陰性の比率に有意差が生じた。
Guandong省の保健委員会は、18〜65歳の軽症・中等症・重症のCovid-19による肺炎患者の治療に関して、リン酸CQ錠500mg1日2回, 10日間の投与を推奨した。より短期間のregimen(i.e. 5日vs10日)は副作用を減少させる可能性があるものの、抗ウイルス作用を減じる可能性もある。そのため、投与総量に関する明確な推奨は存在しない。
多くの国で既に重症Covid-19患者へのCQ or HCQの人道的な使用が正式に適応となっていることを考慮すると、比較対象となるプラセボ群が不足しているために適切な有効性を検証することは非倫理的であろう。本studyでは、重症Covid-19治療におけるCQの2つの異なる用量の安全性, 及び有効性を評価することを目的としている。
(2) Method
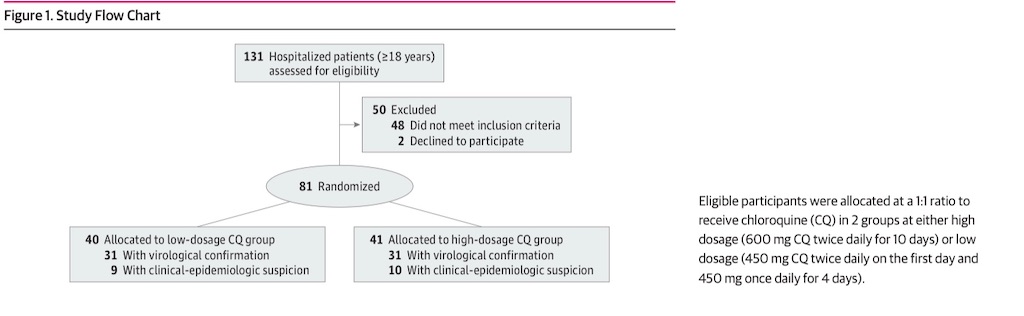
本studyは並行, 二重盲検, ランダム化されたphase IIbの臨床試験であり、2020年3月23日に開始され、ブラジルのマナウスにあるHospital e Pronto-Soccurro Delphina Rinaldi Abdel Azizにて行われた。
① Patient selection
以下の条件に合致する患者が本studyへ登録された。
- 臨床的にCovid-19を疑う(i.e. 発熱と呼吸器症状の病歴)
- 18歳以上
- 呼吸数>24 and/or 心拍数>125 and/or SpO2<90 %(室内気) and/or ショック(i.e. 血圧<65 mmHg)
ランダム化を遅らせないために、Covid-19が検査で確認される前に患者は登録された。Figure 1にflow chartを示す。患者は1:1の比率で、以下のグループへ割り振られた。
なお観察バイアスを最小にするため、ランダム化のリストは薬剤師しか閲覧できなかった。参加者のランダム化は薬剤師によって行われ、割り当てられたstudy numberによってのみ参加者の特定がなされた。有害事象が見られた場合、Data Safety and Monitoring Board(DSMB)のメンバーが盲検化されていない情報にアクセスし, 計画になかったpreliminary analysisが計画されていたinterim analysesの前に実施され、両群(高用量と低用量群双方)の早期中止を指導した。この時点で、25%以上の死亡率が認められ, 重篤な循環器系有害事象が報告されていた。
② Intervention: 高用量(600 mgのCQ); 150 mg錠剤4錠を1日2回, 10日間(=合計 12 gのCQ)
③ Comparison: 低用量(450 mgのCQ); 0日目は150 mg錠剤3錠とプラセボ1錠を1日2回, 1〜4日目は150 mg錠剤3錠とプラセボ1錠を1日1回・その後プラセボ4錠, 5〜9日目はプラセボ4錠を1日2回(=合計 2.7 gのCQ)
本studyの基準に合致する全患者(i.e. ARDS)には、0日目からセフトリアキソン(1g 1日2回, 7日間)とアジスロマイシン(500mg 1日1回, 5日間)の投与が行われた。またインフルエンザの感染が疑われた場合(アマゾンでは1~4月の間がインフルエンザのシーズンである)は、オセルタミビル(75 mg 1日2回, 5日間)も処方された。
④ Outcome
1. Satety Outcome
治療中に起きた有害事象, 重篤な有害事象, そして 早期or一時的な投与中止
2. Primary End Point
「28日目までに、高用量群の死亡率は低用量群のそれの半分となる」という仮説を立てていたので、primary end pointは28日目までの死亡と設定した。
3. Secondary End Point
- 13日目と28日目の死亡
- 参加者の状態
- 検査結果
- 13日目と28日目の心電図
- 入院中の毎日の経過
- 機械的換気・酸素療法の行われた期間
- 治療開始から死亡までの期間
今回は13日目までの分析を示し、死亡をprimary outcomeとする。 ウイルスRNAの検査は0日, 4日目に実施した。
Primary outcome(i.e. 死亡率の低減)に必要なsample sizeは、重症患者の死亡率が20 %である, 高用量のCQ投与は低用量群と比較して50 %死亡を低減させるであろう, という推測に基づいて計算した。そのため、同じ規模の2群間の比率の違いの検定を考慮すると、394名の参加者(各群に197名)が必要であった。10 %の喪失を加えると、最終的に440名の参加者が必要と考えられた。
(3) Result
① 参加者の特性
合計81名の患者がランダム化され、40名(49.4 %)が低用量群へ, 41名(50.6 %)が高用量群へ割り振られた(Figure 1)。DSMBの勧告に基づき、preliminary analysisは2020年の4月5日に行われ、その時点で11名(高用量群で7名[63.6 %], 低用量群で4名[36.4 %])が死亡していた。大半の患者(81名中62名[76.5 %])は後になってRT-PCRでCovid-19と診断された(低用量群で31名[77.5 %], 高用量群で31名[75.6 %])。なお確定診断を得ていなくても、臨床的かつ疫学的にCovid-19と合う患者も一緒に分析された。
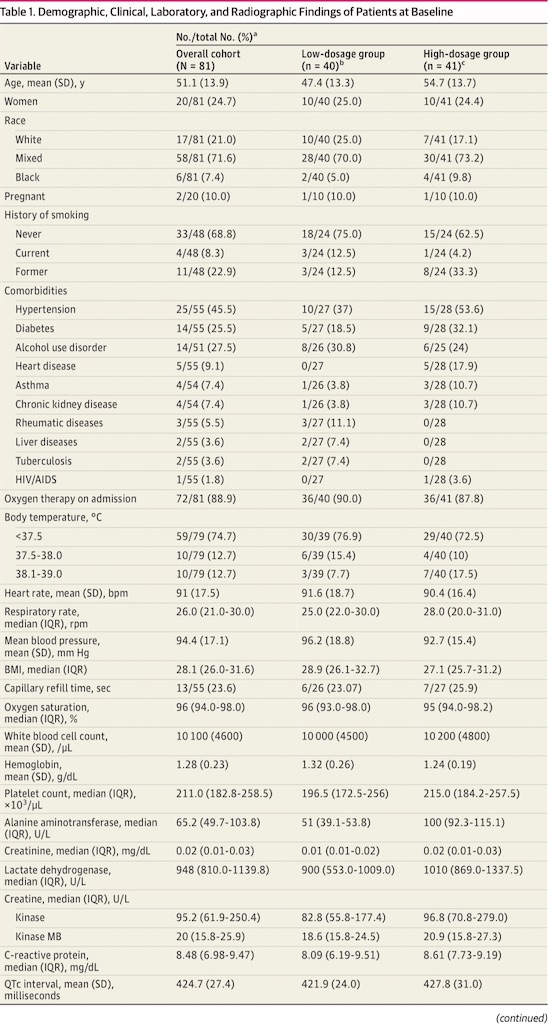
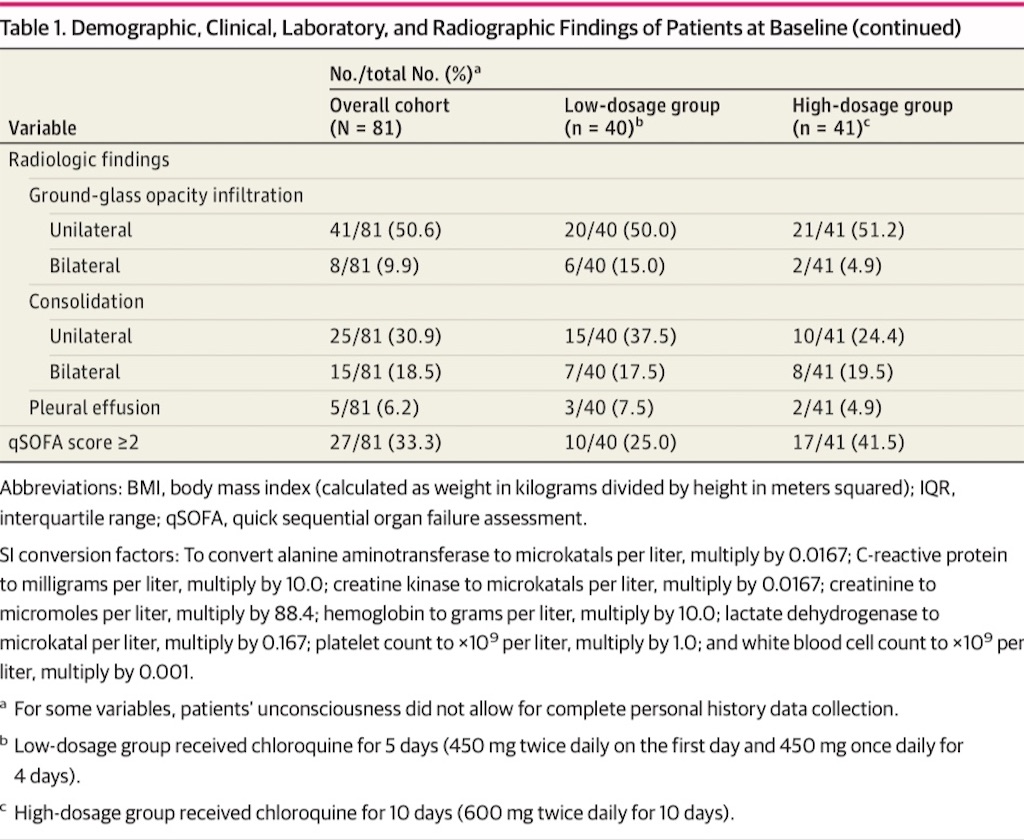
全体, 及びグループごとのbaselineの特性をTable 1に示す。全体の平均年齢は51.1(SD; 13.9)で男性が優位であった(60名[75.3 %])。高血圧, アルコール使用障害, 糖尿病が最も多い並存疾患だった。高用量群はより高齢で(平均[SD]年齢; 54.7[13.7] vs 47.4[13.3]), 心疾患が多かった(28名中5名[17.9 %] vs 0名)。
心筋炎の発症(「Creatine Kinase-MB[CKMB]が正常上限の2倍超」と定義)は26名中2名(7.7 %; 各群ごとに1名)だった。心エコーは実施されなかった。全患者がアジスロマイシン投与を受け、低用量群で86.8 %(38名中33名), 高用量群で92.5 %(40名中37名)がオセルタミビルを投与された。
② Safety Outcome

Creatine phosphokinase(CK)は33名中13名(39.4 %), CKMBは26名中10名(38.4 %)で上昇していた。Covid-19と診断された患者のみを考慮すると、CKは25名中9名(37.5 %), CKMBは22名中7名(31.8 %)で上昇しており、低用量群よりも高用量群でCKが上昇した患者が多く見られた(14名中7名[50.0 %] vs 19名中6名[31.6 %])。1名のみが横紋筋融解症を発症し、その原因はウイルス, もしくはCQいずれでもあり得た(Table 2)。全体では、73名中11名(15.1 %)で500ミリ秒以上のQTc間隔(Fridericia methodで補正)延長が見られ、Covid-19と診断された患者においては57名中8名(14.0 %)でQT延長が見られた。また500ミリ秒以上のQTc延長は、低用量群よりも高用量群で多く見られた(37名中7名[18.9 %] vs 36名中4名[11.1 %])。高用量群内でCovid-19と診断されていた37名中2名(2.7 %)では心室頻拍を来し、その後の死亡した(なおtorsade de pointesは来していない)。両群でbody massは類似していた。
42名中11名(26.2 %)でヘモグロビン減少が見られた。38名中16名(42.1 %)ではクレアチニン増加が見られた。
③ Lehtality Outcome
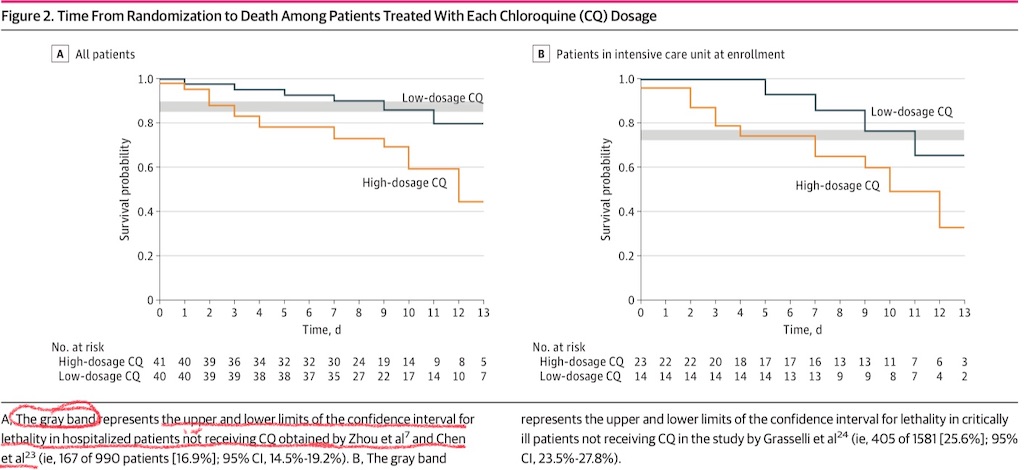
全体での死亡率は27.2 %(95%CI; 17.9~38.2 %)であり、この95%CIは、CQを投与されていない患者を含む2つの大規模studyに基づくmeta-analysisの95%CI(14.5~19.2 %)と重複する。本studyのgroupごとの生存は、CQを投与されていない2つの類似したstudy由来のデータと比較された(Figure 2A)。死亡率は高用量群で39.0 %(41名中16名), 低用量群で15.0 %(40名中6名)だった。Survival analysisにて両群は過去のデータと類似しており、高用量群で死亡数が多かったにも関わらず、有意差が見られなかった(log-rank -2.183; P=.03)。慢性心疾患のある患者5名(6.2 %)を除外した類似のsurvival analysisを行い、類似の結果が見られた(log-rank -2.188; P=.03)。低用量群中の死亡患者では6名中5名(83.3 %), 高用量群のそれでは16名中14名(87.5 %)にてウイルスRNAが検出された。
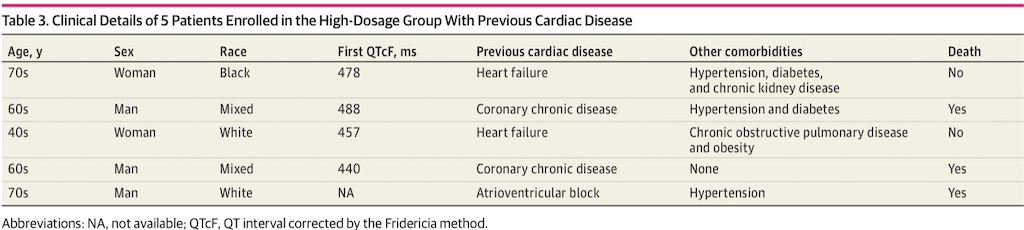
高用量群は死亡と関連していた(odds ratio 3.5; 95%CI 1.2~10.6)。サンプルサイズが小さいにも関わらず、探索的な多変量解析において年齢でcontrolした場合、高用量CQは死亡と関連していなかった(odds ratio 2.8; 95%CI 0.9~8.5)。慢性心疾患のある5名中、3名(60.0 %)が死亡した; その患者の臨床経過詳細をTable 3に示す。QTc延長が最初に生じた日と死亡日の間に明らかな関連性は見られなかったし, 死亡した患者間での累積投与量との関連性も見られなかった。全体として、死亡した22名中19名(86.4 %)で死亡前にSARS-CoV-2のウイルス学的診断がなされていた。高用量CQが仮説と逆の結果になったこれらの結果に基づき、DSMBは全年齢での高用量群の迅速な中断と, 全患者の非盲検化, 低用量群へ戻すことを勧告した。
重症患者を含めたsubgroupの分析を実施し(Figure 2B)、両群間で死亡率に差が見られなかった。
0日目と4日目に、合計27名から鼻咽頭and/or口咽頭サンプルが収集され、6名だけが4日目に陰性となっていた(22.2 %)。
(4) Discussion
重症Covid-19患者という文脈においては、利益が有害作用を上回ることから、本studyは高用量regimen使用を止めるのに十分なred flagを掲げている。
本studyでは既に全患者がアジスロマイシン投与を受けていたため、CQの毒性を独立して評価することができなかった。相乗的に心毒性を来す可能性があるため、中国の公式な勧奨ではCQとアジスロマイシンの非同時使用に注意を呼びかけている。本studyでは、インフルエンザ感染を疑われたことから大半の患者(89.6 %)へオセルタミビル投与も行われたが、オセルタミビルもQTc間隔を延長させ, 心毒性を来す可能性がある。相乗的な心毒性に関する結論は、現在世界中で進行中のstudyの結果を参考にすることで可能になるかもしれない。
本srudyが計画された時点で、ブラジル規制当局と保健省は医師の裁量によるCovid-19患者へのCQ, HCQの人道的使用を承認した。これはplacebo-controlled trialを行うことへの要請ではなかったものの、プラセボによる治療を患者に行うランダム化臨床試験を行うことに対して倫理的なジレンマを引き起こした。プラセボ群がないので、本studyはCQを使用していない極めて類似した過去の患者データを用いねばならなかった。本studyの死亡率は低くなかった; しかしながら、CQに利益がないとも確実には断言できない。CQをルーチンに使用していない国でplacebo-controlled studyが現在行われている。複数の現在進行中の臨床試験では、早期のCQ使用も強調されている。このような情報は、よくデザインされたplacebo-controlledの二重盲検ランダム化試験において緊急で必要とされている。
この論文の筆者らは、元々計画していたsample sizeに達するまで低用量群への患者の登録を行っている。低用量regimenを使用する患者に対するフォローアップと毒性のモニタリングの必要性が、この意思決定を支持している。placebo-controlled trialが終了するまでの間、低用量群から得られた安全性に関するデータは、重症Covid-19に対する人道的治療としての合理的なCQ使用のガイドラインを改善するに当たって極めて有用となるであろう。本studyに残っている全患者に対し、最新のinformed concentを供するようお願いしており, またinformed concentも適切に改定を行っている。
CQは呼吸器系分泌物内のウイルス量を低減させる可能性もあるが、本studyのデータではそのような効果のevidenceは示されなかった。CQを使っている患者(投与量に関係なく)において、アジスロマイシンを併用していたにも関わらず、4日目までに相当量のウイルスを排除したとするevidenceを示すことはできなかった。
CQとHCQの間で、心毒性が異なると示す文献はない; 唯一の懸念は眼球である。本研究では500ミリ秒以上のQTc延長が73名中11名(15.1 %)に見られており、これはHCQを投与されているCovid-19患者における報告(11.0 %)と類似した値である。CQ投与は筋炎とも関連している。本studyでは1名が横紋筋融解症を発症し、CQ投与が中止された。2名の患者では、入院1日目以降のCKMB上昇から心筋炎が疑われた。このような症例では、QTcを延長させる薬剤が重症不整脈を起こす可能性がある。不幸にも、おそらく小さいsample sizeのため、高用量群では低用量群よりも心疾患のある高齢患者が多く含まれてしまった。そのため、グループごとの死亡率に関する結論に当たってはこれがlimitationとなってしまう。本studyのsampleでは、年齢ないし並存疾患が何であれ実用的なdesignへあらゆるタイプの患者を登録するという意思決定が、Covid-19の重症患者内で前もって予想されていた高い死亡率と, protocolを設計する時点でCQのrisk-benefitの推定が不正確であったこと, に基づいて行われていた。本studyの結果より、いかなるCQを使用する治療 ないし 重症Covid-19患者向けのprotocol設計においては、QTc間隔の評価, 緊密な連日のmonitoring, 必要時の用量調整を含めるべきことが明らかになった。
本studyの重症患者間の死亡率は、イタリア Lombardyにおける、CQ投与を受けていない大規模なhistorical sample-size cohortよりも高かった。これは、2国間のICUの質の差, もしくは 重症Covid-19患者におけるCQの有害な作用or効果の不足を反映しているのかもしれない。
本studyのstrengthとして、以下のようなものが挙げられる。
- 二重盲検化されている
- 公的な病院で実施された
- DSMBが関与することで良質なclinical practiceを遵守した
- 重症Covid-19患者に対し、初めて異なる用量のCQの使用を評価した
一方で以下のようなlimitationも指摘される。
- Sample sizeが小さい
- 1施設のみの参加である
- Placebo対照群がない
- BaselineのQTc間隔に基づくexclusion criteriaがない
病院で1日2回の薬剤投与のmonitoringを施行できなかったため、per-protocol analysisは行っていない。経過中にCTの注意深い分析を行うことができなかったため、本articleにおいてはbaselineの画像所見のみ示している。画像所見データと完全な効果に関するデータは後日発表予定である。
(5) Conclusion
本studyにおいて、10日間にわたる高用量(12 g)のCQとアジスロマイシン, オセルタミビルの併用は、投与を継続するに当たって安全性が不足していた。年齢は重要な交絡因子であり、不良なoutcomeと関連していたかもしれない。重症Covid-19患者の治療に、同じ用量を投与することはもはや推奨されない。本studyの患者における死亡を考慮すると、CQの利益は明らかでない。Covid-19治療におけるCQ, ないしHCQの役割のより良好な理解に当たって、以下のstepが推奨される。
1. CQ/HCQの予防薬としての役割を評価するランダム化臨床試験
2. 軽症もしくは中等症のCovid-19患者へ投与し、Covid-19悪化に対して効果があるのか評価するランダム化臨床試験