原子構造の続きと イオン結合 共有結合の話です
↓
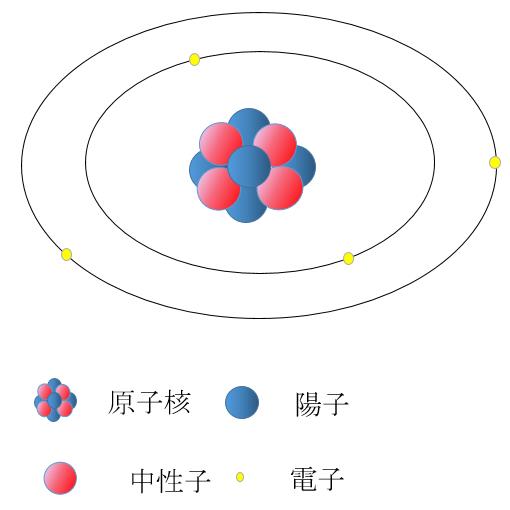
原子の構造は前に書きましたが
原子は陽子と中性子からなる原子核と
その周りをまわる電子からできています
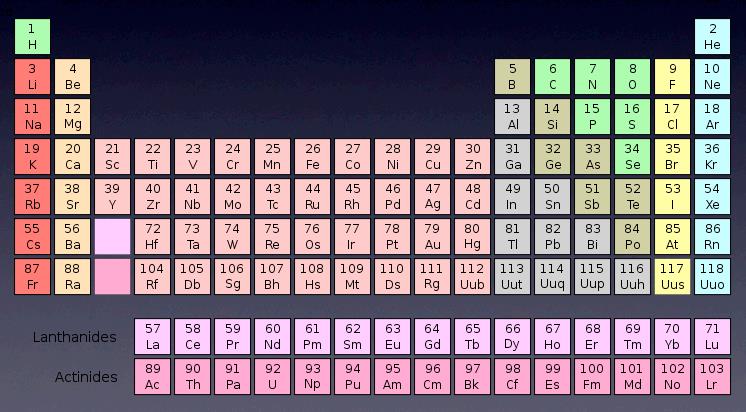
陽子の数で原子の性質は決まりますが 陽子数の順番に並べた
ものが周期表です(上の右)
陽子と中性子は何でて来ているのか?といえば
クォークといる素粒子でできています
クォークは何でできているのか?最小単位の物質なのか?
真実はどこに?いつか解明される日が楽しみですね
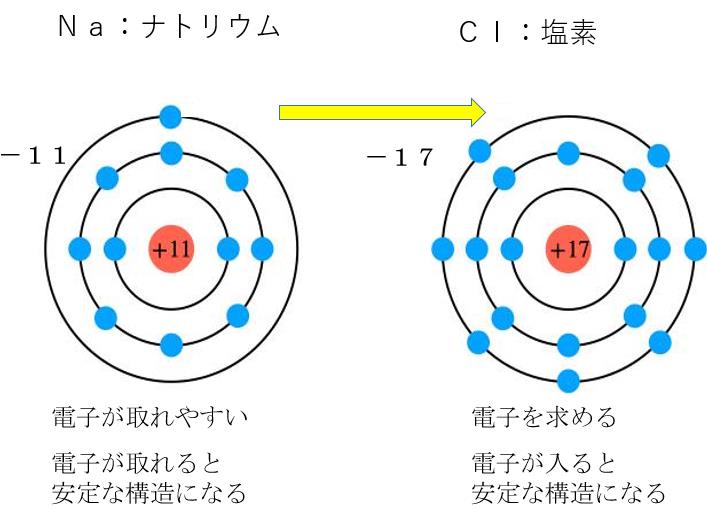
原子の構造をナトリウムと塩素を例に見てみると
陽子と電子の数が同じであれば 電気的に中性です
原子核は陽子で正の電荷をもっているので
電子を引き付ける力がありますが その力は原子によって違います
電子によっても違います
詳しい話は別に書きますが
例えばナトリウムの一番外の電子(最外殻電子)は
非常に取れやすいつまり取れるのにエネルギーがいらない
(イオン化エネルギーが小さい)
さらには 電子が一つ取れると安定な電子配置になる(これも別記)
というわけで 電子が取れやすい状態にあります
近くに塩素原子があれば電子を渡します。
塩素は電子を引き付ける力が強く さらに電子を得ると安定な構造になります
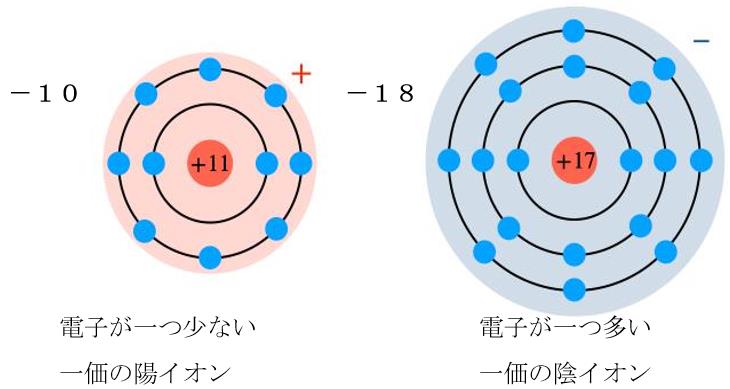
電子をひとつ失ったナトリウムは
陽子の方が数が1個が多い 一価の陽イオンとなり
電子をひとつ得た塩素は
電子の方が数が1個多い 一価の陰イオンとなります
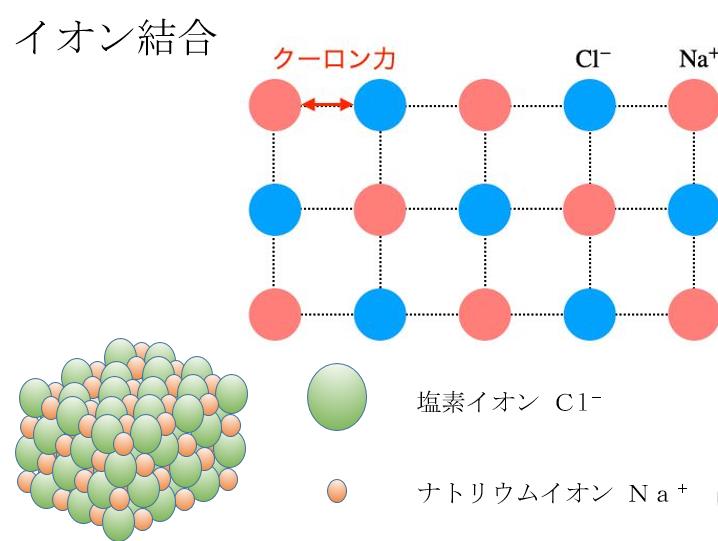
イオンとなった ナトリウムイオンと塩素イオンは
クーロン力によって引き合います。
これが上の図の左下の様に結晶化します
一方で水素と水が共有結合を考えます
水素は一価の陽イオンとなりますし
酸素も二価の陰イオンとなりますので、
水素イオンが二個と酸素イオンがイオン結合すると思われますが
イオン化せずに 電子を共有する
(どこがちがうとどうなるのか? このあたりはまた後日、、)
電子の共有結合は
上の左下のように書くとわかりやすいですね
水素の1個の電子を酸素と共有し
酸素の1個の電子を二個の水素と共有することで
水素は2個の最外殻電子を 酸素は8個の最外殻電子を
もって安定な構造になる
という考え方になります
しかし、実際には右下の様に
電子を中心に考えると
電子は水素の周り(軌道)と酸素の周り(軌道)両方を回る
ということです
両方を回っているのですが
核が電子を引き付ける力は酸素の方が強いので
電子は酸素の軌道に長くいる(水素の周りが短い)
このイメージがとても大事です
これによって分子内の極性が生じる、、、ここもめっちゃ大事なので
ここは別に書きますね